Komponen Penyusun Enzim Protein, Kofaktor, dan Koenzim
Pernah terpikir bagaimana reaksi kimia super cepat di dalam tubuhmu bisa terjadi? Rahasianya ada pada enzim, mesin-mesin molekuler mungil yang mengatur hampir semua proses kehidupan. Tapi, tahu nggak sih apa aja yang membentuk mesin ajaib ini? Lebih dari sekadar protein biasa, enzim ternyata punya komponen pendukung yang bikin kinerjanya optimal. Yuk, kita bongkar rahasia komponen penyusun enzim!
Enzim, biokatalis yang luar biasa efisien, tak bekerja sendirian. Mereka membutuhkan komponen-komponen khusus, seperti protein, kofaktor, dan koenzim, untuk menjalankan fungsinya. Kombinasi unik dari komponen-komponen ini menentukan spesifisitas dan efisiensi enzim dalam mengkatalisis reaksi biokimia yang vital bagi kehidupan. Mari kita telusuri lebih dalam bagaimana komponen-komponen ini berinteraksi dan berkontribusi pada keajaiban biologi.
Definisi dan Sifat Enzim
Enzim, biasa disebut sebagai “mesin molekuler” kehidupan, merupakan biomolekul ajaib yang berperan krusial dalam berbagai reaksi biokimia di dalam tubuh makhluk hidup. Tanpa enzim, reaksi-reaksi penting ini akan berlangsung sangat lambat, bahkan mungkin tak terjadi sama sekali. Bayangkan metabolismemu berjalan super lemot—nggak asyik, kan? Nah, enzimlah yang membuat semuanya berjalan lancar.
Definisi Enzim Secara Biokimia
Secara biokimia, enzim didefinisikan sebagai biokatalis protein (kecuali ribozim, yang merupakan RNA) yang mempercepat laju reaksi kimia tanpa ikut bereaksi atau berubah secara permanen. Mereka bekerja dengan cara menurunkan energi aktivasi, yaitu energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Dengan kata lain, enzim bertindak sebagai “jembatan” yang mempermudah molekul-molekul reaktan (substrat) untuk bereaksi.
Sifat-Sifat Umum Enzim
Enzim punya beberapa sifat unik yang membedakannya dari katalis kimia biasa. Salah satu sifat paling penting adalah spesifisitasnya: enzim hanya akan mengkatalisis reaksi tertentu dengan substrat spesifik. Bayangkan kunci dan gembok—hanya kunci yang tepat yang bisa membuka gembok tertentu. Selain itu, aktivitas enzim juga sangat dipengaruhi oleh faktor lingkungan seperti suhu dan pH. Suhu dan pH yang ekstrem dapat menyebabkan enzim mengalami denaturasi, yaitu perubahan struktur tiga dimensi yang mengakibatkan hilangnya aktivitas katalitik.
Contoh Enzim dan Reaksi yang Dikatalisisnya
Ada banyak sekali jenis enzim dengan fungsi yang beragam. Sebagai contoh, enzim amilase mengkatalisis hidrolisis pati menjadi gula sederhana, sementara enzim protease memecah protein menjadi asam amino. Enzim lipase juga punya peran penting, yaitu memecah lemak menjadi asam lemak dan gliserol. Ketiga enzim ini berperan penting dalam pencernaan makanan kita.
Perbandingan Tiga Jenis Enzim Berdasarkan Mekanisme Kerja
Enzim diklasifikasikan berdasarkan mekanisme kerjanya. Berikut perbandingan tiga jenis enzim yang umum:
| Jenis Enzim | Mekanisme Kerja | Contoh | Reaksi yang Dikatalisis |
|---|---|---|---|
| Oksidoreduktase | Mengkatalisis reaksi redoks (transfer elektron) | Laktat dehidrogenase | Konversi laktat menjadi piruvat |
| Transferase | Memindahkan gugus fungsi dari satu molekul ke molekul lain | Kinase | Transfer gugus fosfat |
| Hidrolase | Mengkatalisis hidrolisis (pemecahan molekul dengan penambahan air) | Amilase | Hidrolisis pati menjadi maltosa |
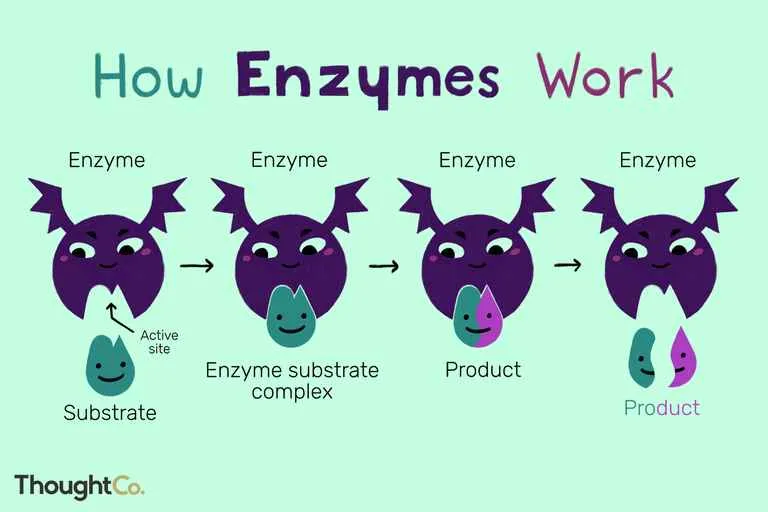
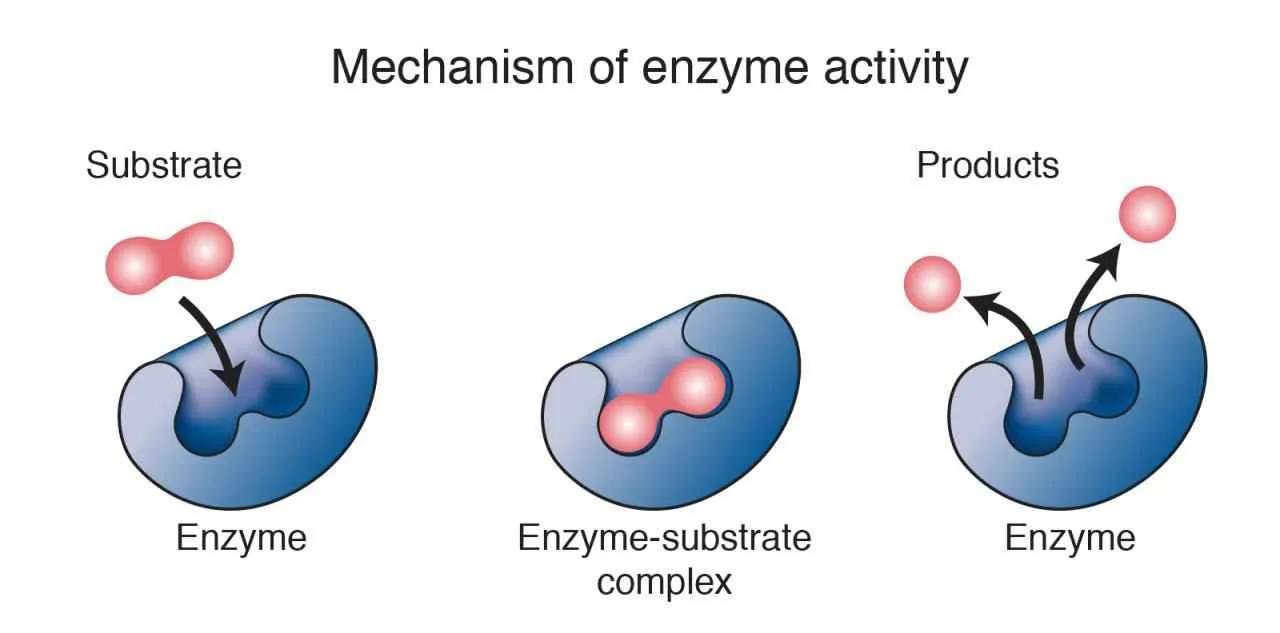
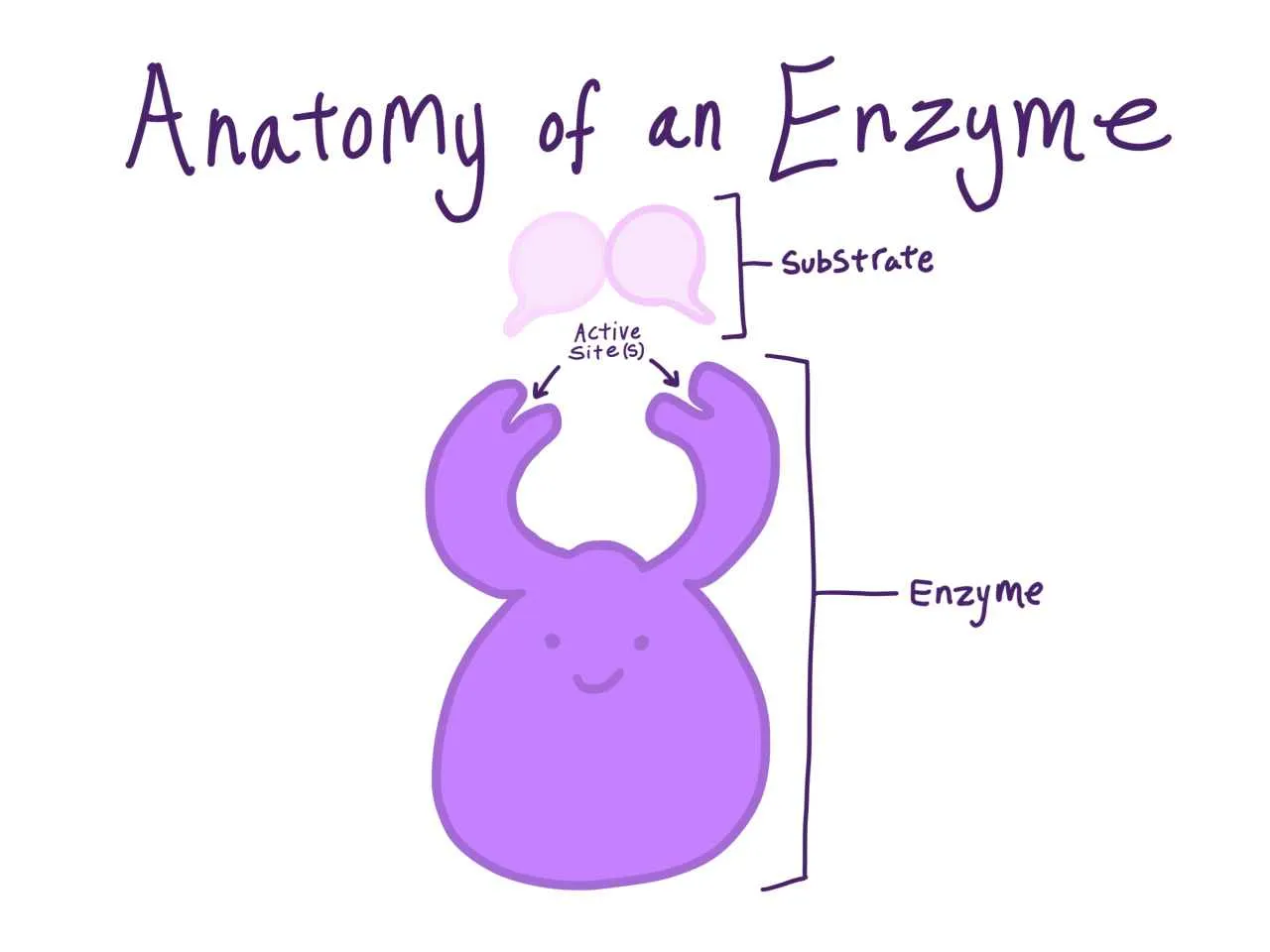
Struktur Enzim dan Situs Aktif
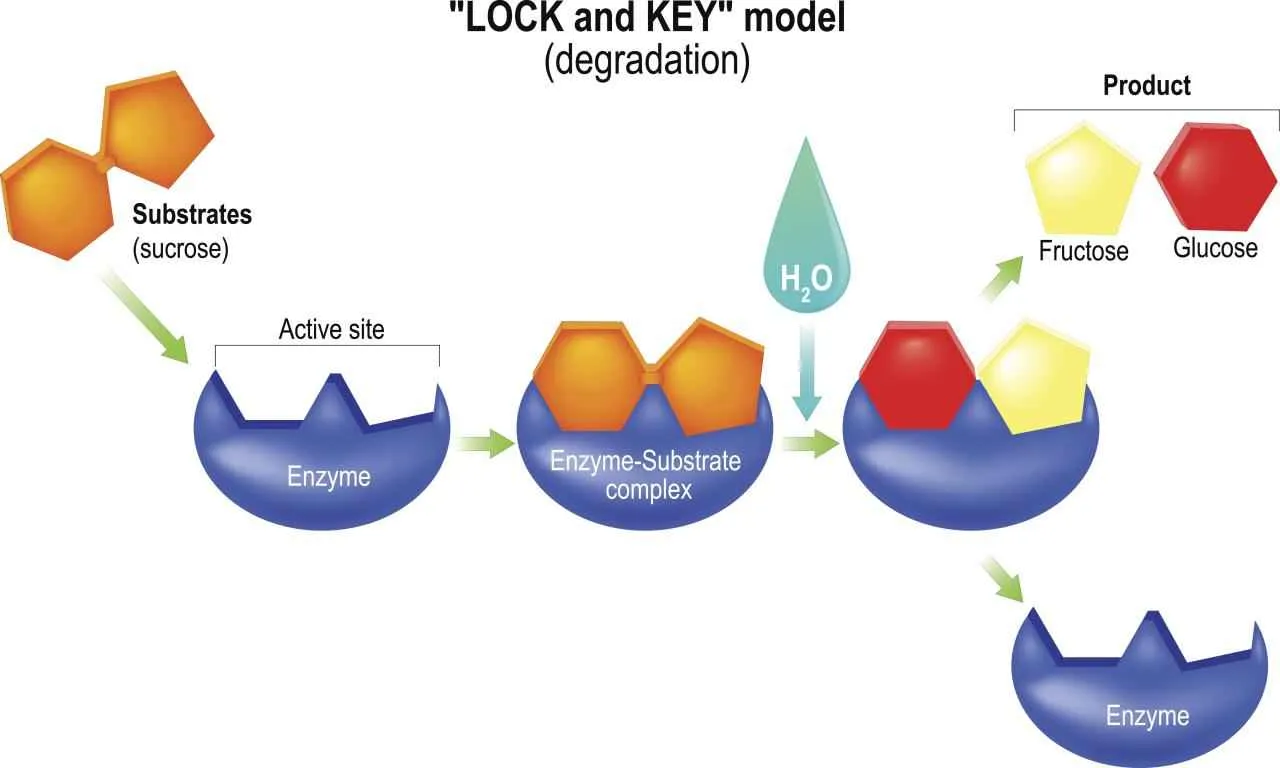
Enzim umumnya berupa protein globular dengan struktur tiga dimensi yang kompleks. Struktur ini sangat penting untuk fungsi katalitiknya. Di dalam struktur enzim terdapat daerah khusus yang disebut situs aktif. Situs aktif adalah tempat substrat berikatan dan reaksi katalitik berlangsung. Struktur situs aktif sangat spesifik dan hanya dapat berikatan dengan substrat tertentu. Proses pengikatan substrat pada situs aktif seringkali melibatkan interaksi non-kovalen seperti ikatan hidrogen, ikatan ionik, dan interaksi hidrofobik. Setelah substrat terikat, enzim akan mengubah bentuknya sedikit (induced fit) untuk mengoptimalkan reaksi katalitik. Setelah reaksi selesai, produk akan terlepas dari situs aktif, dan enzim kembali ke bentuk semula, siap mengkatalisis reaksi berikutnya.
Komponen Penyusun Enzim
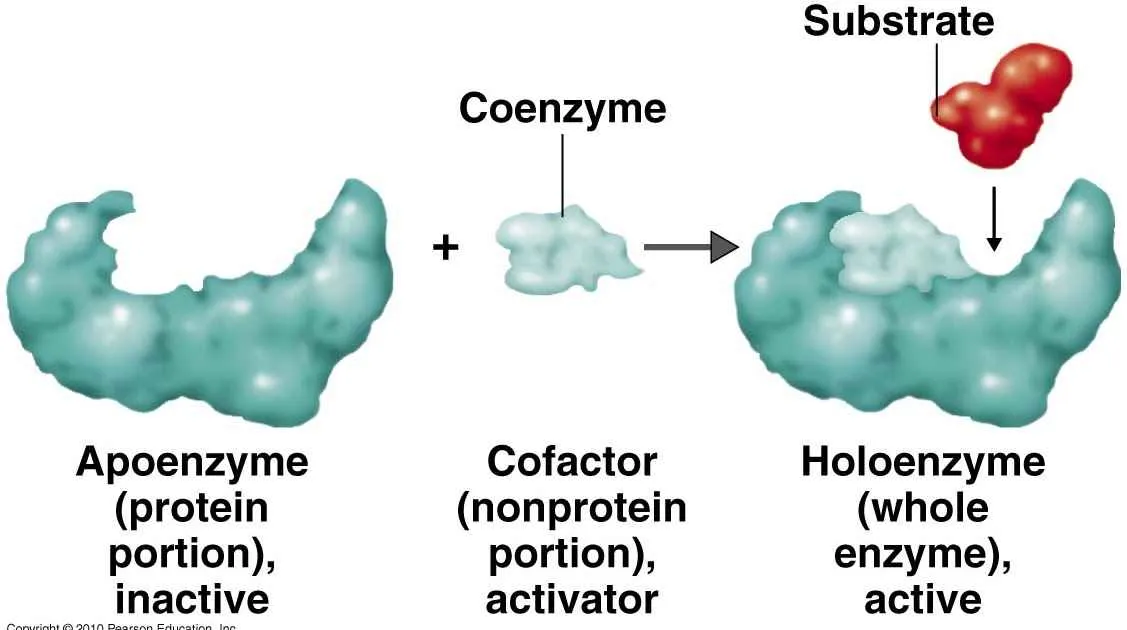
Enzim, si pahlawan tak terlihat dalam tubuh kita, bertanggung jawab atas ribuan reaksi biokimia yang menjaga kita tetap hidup. Kehebatannya terletak pada struktur uniknya, terutama bagian protein yang membentuk kerangka dan menentukan fungsinya. Yuk, kita bongkar rahasia di balik struktur protein enzim!
Asam Amino Penyusun Enzim
Tahukah kamu? Enzim dibangun dari berbagai jenis asam amino, blok bangunan protein. Beberapa asam amino yang umum ditemukan dalam struktur enzim antara lain alanin, glisin, leusin, valin, dan asam aspartat. Komposisi dan urutan asam amino inilah yang menentukan bentuk tiga dimensi enzim dan, pada akhirnya, fungsinya.
Peran Ikatan Peptida dan Struktur Protein dalam Fungsi Enzim
Ikatan peptida, ikatan kovalen yang menghubungkan asam amino, berperan krusial dalam membentuk struktur protein enzim. Struktur protein enzim terdiri dari beberapa tingkatan: primer (urutan asam amino), sekunder (struktur α-heliks atau β-sheet), tersier (lipatan tiga dimensi keseluruhan), dan kuartener (interaksi antar subunit protein). Setiap tingkatan struktur ini berkontribusi pada fungsi enzim, mulai dari pembentukan sisi aktif hingga interaksi dengan substrat.
Misalnya, struktur α-heliks memberikan kekakuan dan stabilitas pada enzim, sementara struktur β-sheet memungkinkan fleksibilitas yang dibutuhkan untuk berinteraksi dengan substrat. Struktur tersier dan kuartener yang kompleks menciptakan lingkungan mikro spesifik di sisi aktif enzim, tempat substrat berikatan dan reaksi berlangsung.
Modifikasi Pasca-Translasi dan Aktivitas Enzim
Setelah disintesis, protein enzim sering mengalami modifikasi pasca-translasi. Modifikasi ini, seperti glikosilasi (penambahan gula) atau fosforilasi (penambahan gugus fosfat), dapat mengubah aktivitas enzim. Beberapa modifikasi dapat meningkatkan aktivitas enzim, sementara yang lain dapat menghambatnya. Proses ini merupakan mekanisme pengaturan yang penting dalam sel.
Sebagai contoh, glikosilasi dapat meningkatkan stabilitas enzim atau memfasilitasi interaksi dengan molekul lain. Sementara itu, fosforilasi dapat mengaktifkan atau menonaktifkan enzim, tergantung pada lokasi dan jenis residu asam amino yang dimodifikasi. Bayangkan seperti sebuah saklar yang mengontrol kinerja enzim.
Struktur Protein Enzim dan Spesifisitasnya
Spesifisitas enzim, kemampuannya untuk mengkatalisis reaksi hanya pada substrat tertentu, ditentukan oleh struktur tiga dimensinya. Sisi aktif enzim, wilayah spesifik yang berikatan dengan substrat, memiliki bentuk dan sifat kimia yang unik yang hanya cocok dengan substrat tertentu. Interaksi antara sisi aktif dan substrat seperti kunci dan gembok, memastikan reaksi berlangsung dengan efisien dan spesifik.
Contoh Kode Urutan Asam Amino dan Pengaruhnya terhadap Lipatan Protein
Mari kita lihat contoh sederhana. Urutan asam amino pendek seperti “Gly-Ala-Leu-Val” akan melipat berbeda dibandingkan dengan “Asp-Glu-Lys-Arg”. Asam amino hidrofobik (seperti Leu dan Val) cenderung berada di bagian dalam protein yang jauh dari air, sementara asam amino hidrofilik (seperti Asp dan Glu) cenderung berada di permukaan protein yang berinteraksi dengan air. Perbedaan ini akan memengaruhi bentuk tiga dimensi protein dan, pada akhirnya, fungsinya sebagai enzim.
Urutan asam amino menentukan bagaimana rantai polipeptida akan melipat menjadi struktur tiga dimensi yang unik. Lipatan ini menciptakan sisi aktif yang spesifik, memungkinkan enzim untuk mengenali dan mengikat substrat tertentu. Bahkan perubahan kecil dalam urutan asam amino dapat menyebabkan perubahan signifikan dalam struktur dan fungsi enzim.
Komponen Penyusun Enzim
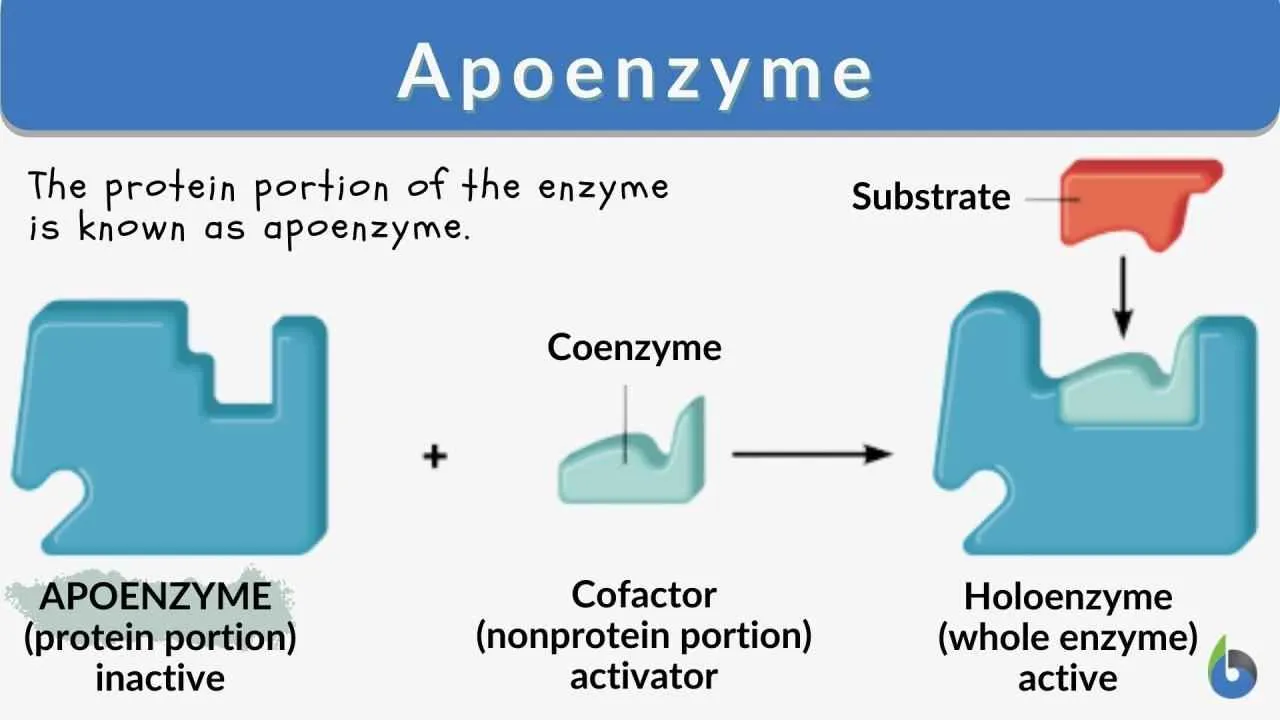
Enzim, si pahlawan tak terlihat dalam tubuh kita, bertanggung jawab atas ribuan reaksi biokimia yang menjaga kita tetap hidup. Kehebatannya nggak cuma terletak pada kemampuannya mempercepat reaksi, tapi juga pada komponen penyusunnya yang unik dan krusial. Salah satu kunci utama kinerja enzim adalah keberadaan kofaktor dan koenzim. Bayangkan enzim sebagai sebuah mesin canggih, dan kofaktor serta koenzim adalah komponen tambahan yang membuatnya bisa beroperasi secara optimal. Tanpa mereka, mesin enzim bisa mogok!
Perbedaan Kofaktor dan Koenzim
Kofaktor dan koenzim, keduanya adalah komponen non-protein yang dibutuhkan enzim untuk menjalankan fungsinya sebagai katalis. Bedanya? Kofaktor biasanya berupa ion logam, seperti besi (Fe2+), seng (Zn2+), atau magnesium (Mg2+), yang terikat erat pada enzim. Sementara koenzim adalah molekul organik kompleks, seringkali merupakan derivat vitamin, yang terikat sementara pada enzim selama reaksi berlangsung. Bayangkan kofaktor sebagai sekrup yang terpasang permanen pada mesin, sedangkan koenzim seperti baut yang bisa dilepas pasang.
Contoh Kofaktor Logam dan Perannya
Kofaktor logam punya peran penting dalam aktivitas katalitik enzim. Misalnya, ion besi (Fe2+) dalam hemoglobin berperan vital dalam mengikat dan mengangkut oksigen di darah. Ion seng (Zn2+) pada enzim karboanhidrase membantu mempercepat reaksi hidrasi karbon dioksida menjadi asam karbonat, proses penting dalam regulasi pH darah. Sementara magnesium (Mg2+) sering berperan sebagai jembatan untuk mengikat substrat pada enzim, meningkatkan efisiensi reaksi.
Koenzim Penting dan Prekursor Vitaminnya
Banyak koenzim merupakan turunan dari vitamin. Hal ini menegaskan betapa pentingnya mengonsumsi makanan bergizi seimbang! Contohnya, NAD+ (nicotinamide adenine dinucleotide) dan FAD (flavin adenine dinucleotide) merupakan koenzim penting dalam reaksi redoks (reduksi-oksidasi) yang berperan dalam metabolisme energi. NAD+ berasal dari vitamin B3 (niacin), sementara FAD berasal dari vitamin B2 (riboflavin). Koenzim A (CoA), yang berperan dalam metabolisme asam lemak, juga bergantung pada vitamin B5 (asam pantotenat).
Contoh Enzim, Kofaktor/Koenzim, dan Fungsinya
| Enzim | Kofaktor/Koenzim | Fungsi |
|---|---|---|
| Hemoglobin | Fe2+ (besi) | Mengangkut oksigen |
| Karboanhidrase | Zn2+ (seng) | Mengkatalisis hidrasi CO2 |
| Dehidrogenase laktat | NAD+ (turunan vitamin B3) | Oksidasi laktat |
| Piruvat dehidrogenase | Tiamin pirofosfat (turunan vitamin B1), lipoat, CoA (turunan vitamin B5), FAD (turunan vitamin B2), NAD+ (turunan vitamin B3) | Oksidasi piruvat |
Peran Kofaktor Logam dalam Transfer Elektron
Kofaktor logam, terutama yang memiliki beberapa tingkat oksidasi, berperan penting dalam transfer elektron dalam reaksi enzimatik. Mereka bertindak sebagai pembawa elektron sementara, memfasilitasi perpindahan elektron dari satu molekul ke molekul lain. Proses ini krusial dalam reaksi redoks, seperti respirasi seluler, yang menghasilkan energi untuk sel. Contohnya, ion besi dalam sitokrom berperan dalam rantai transpor elektron mitokondria. Perubahan tingkat oksidasi ion besi memungkinkan transfer elektron yang efisien, menghasilkan ATP, sumber energi utama sel.
Pengaruh Faktor Lingkungan terhadap Aktivitas Enzim
Enzim, si pekerja keras di dalam tubuh kita, ternyata nggak cuma bergantung pada strukturnya sendiri. Kemampuannya bekerja, atau aktivitas enzimatiknya, sangat dipengaruhi oleh kondisi lingkungan sekitarnya. Bayangkan enzim sebagai atlet; mereka butuh kondisi prima untuk berprestasi maksimal. Kondisi lingkungan yang kurang ideal bisa bikin performa mereka menurun, bahkan sampai “knock out”! Nah, faktor lingkungan yang paling berpengaruh adalah pH, suhu, dan konsentrasi substrat. Yuk, kita bahas satu per satu!
Pengaruh pH terhadap Aktivitas Enzim
Setiap enzim punya rentang pH optimal yang bikin mereka bekerja paling efisien. Di luar rentang ini, aktivitas enzim akan menurun. Ini karena perubahan pH dapat mengubah struktur tiga dimensi enzim, terutama pada gugus R asam amino yang berperan dalam pembentukan situs aktif. Sebagai contoh, enzim pepsin di lambung bekerja optimal pada pH asam (sekitar 2), sementara enzim tripsin di usus halus bekerja optimal pada pH netral (sekitar 7). Grafik berikut menggambarkan hubungan antara pH dan aktivitas enzim:
(Ilustrasi Grafik: Grafik garis yang menunjukkan kurva lonceng. Sumbu X menunjukkan nilai pH, sumbu Y menunjukkan aktivitas enzim. Kurva menunjukkan aktivitas enzim meningkat hingga mencapai titik puncak pada pH optimal, kemudian menurun seiring penyimpangan dari pH optimal. Titik puncak kurva mewakili pH optimal enzim tersebut.)
Pengaruh Suhu terhadap Aktivitas Enzim
Suhu juga berpengaruh besar terhadap aktivitas enzim. Peningkatan suhu awal dapat meningkatkan energi kinetik molekul, sehingga meningkatkan kecepatan reaksi enzimatik. Namun, jika suhu terus meningkat di atas titik optimal, struktur enzim akan mulai terganggu, proses yang dikenal sebagai denaturasi. Denaturasi menyebabkan perubahan bentuk enzim, sehingga situs aktifnya berubah dan enzim kehilangan kemampuan untuk mengikat substrat dan menjalankan fungsinya. Bayangkan protein enzim seperti baju yang disetrika terlalu panas, bentuknya jadi rusak dan nggak bisa dipakai lagi. Setiap enzim memiliki suhu optimal yang berbeda-beda.
Pengaruh Konsentrasi Substrat terhadap Kecepatan Reaksi Enzimatik
Konsentrasi substrat juga berperan penting. Pada konsentrasi substrat rendah, peningkatan konsentrasi substrat akan meningkatkan kecepatan reaksi secara proporsional. Ini karena semakin banyak substrat yang tersedia, semakin banyak enzim yang dapat berikatan dan melakukan reaksi. Namun, pada konsentrasi substrat yang sangat tinggi, kecepatan reaksi akan mencapai titik jenuh. Semua situs aktif enzim sudah terikat substrat, sehingga penambahan substrat selanjutnya tidak akan meningkatkan kecepatan reaksi lebih lanjut. Ini seperti restoran yang sudah penuh, meski ada banyak pelanggan lagi, mereka tetap harus menunggu.
Ilustrasi Pengaruh Suhu dan pH terhadap Struktur dan Fungsi Enzim
(Ilustrasi: Dua gambar enzim. Gambar pertama menunjukkan enzim dengan struktur tiga dimensi yang utuh dan situs aktif yang jelas. Gambar kedua menunjukkan enzim yang strukturnya terganggu, situs aktifnya berubah bentuk, dan terlihat tidak berfungsi. Gambar pertama diberi keterangan “Suhu dan pH optimal”. Gambar kedua diberi keterangan “Suhu dan pH di luar rentang optimal”.)
Percobaan Pengaruh Suhu terhadap Aktivitas Enzim Amilase
Untuk menyelidiki pengaruh suhu terhadap aktivitas enzim amilase, kita bisa melakukan percobaan sederhana. Siapkan larutan amilase dan larutan pati. Bagi larutan tersebut ke dalam beberapa tabung reaksi, lalu panaskan masing-masing tabung pada suhu yang berbeda (misalnya, 0°C, 25°C, 37°C, 50°C, dan 70°C). Setelah beberapa waktu, ukur kadar gula reduksi yang dihasilkan menggunakan uji Benedict atau uji lain yang sesuai. Hasilnya akan menunjukkan aktivitas amilase pada berbagai suhu. Perhatikan perubahan warna sebagai indikator aktivitas enzim. Semakin gelap warnanya, semakin tinggi aktivitas enzim amilase.
Inhibitor Enzim
Enzim, kunci kehidupan yang mengatur reaksi biokimia di dalam tubuh kita, ternyata bisa dihambat! Bayangkan, proses-proses penting yang biasanya berjalan lancar, tiba-tiba terhenti atau melambat. Nah, di sinilah peran inhibitor enzim, molekul-molekul yang bisa mengikat enzim dan mengganggu fungsinya. Mekanisme penghambatannya pun beragam, dan dampaknya bisa sangat signifikan, bahkan dalam dunia medis!
Jenis-jenis Inhibitor Enzim
Inhibitor enzim diklasifikasikan berdasarkan bagaimana mereka berinteraksi dengan enzim. Ada tiga jenis utama: kompetitif, non-kompetitif, dan unkompetitif. Masing-masing memiliki mekanisme dan efek yang berbeda-beda pada aktivitas enzim.
- Inhibitor Kompetitif: Inhibitor ini bersaing dengan substrat untuk mengikat situs aktif enzim. Semakin tinggi konsentrasi inhibitor, semakin besar peluangnya untuk mengikat enzim dan menghambat reaksi. Bayangkan seperti rebutan tempat duduk di bioskop, inhibitor dan substrat berebut tempat yang sama.
- Inhibitor Non-kompetitif: Inhibitor ini mengikat enzim di tempat selain situs aktif, yang disebut situs alosterik. Pengikatan ini mengubah bentuk enzim sehingga menurunkan afinitasnya terhadap substrat, mengurangi kecepatan reaksi. Ini seperti seseorang yang merusak kursi bioskop, sehingga tidak nyaman lagi untuk diduduki.
- Inhibitor Unkompetitif: Jenis inhibitor ini hanya mengikat kompleks enzim-substrat. Kehadirannya mencegah kompleks tersebut membentuk produk, sehingga menghambat reaksi. Ini seperti seseorang yang tiba-tiba datang dan menghalangi proses pembelian tiket bioskop setelah kita sudah antri.
Contoh Inhibitor Enzim dan Mekanisme Kerjanya
Banyak contoh inhibitor enzim ditemukan di alam dan dimanfaatkan dalam berbagai aplikasi, termasuk pengobatan. Berikut beberapa contohnya:
- Methotrexate: Merupakan inhibitor kompetitif dihidrofolat reduktase, enzim penting dalam sintesis DNA. Digunakan dalam kemoterapi untuk menghambat pertumbuhan sel kanker yang cepat membelah.
- Aspirin: Menghambat enzim siklooksigenase (COX), yang berperan dalam produksi prostaglandin, mediator peradangan dan rasa sakit. Oleh karena itu, aspirin digunakan sebagai obat anti-inflamasi dan analgesik.
- Cyanide: Inhibitor non-kompetitif sitokrom c oksidase, enzim penting dalam rantai transpor elektron pada respirasi seluler. Keracunan sianida dapat menyebabkan kematian karena menghambat produksi ATP.
Diagram Mekanisme Kerja Inhibitor Kompetitif dan Non-kompetitif
Berikut ilustrasi sederhana mekanisme kerja inhibitor kompetitif dan non-kompetitif:
Inhibitor Kompetitif: Bayangkan sebuah kunci (substrat) yang pas masuk ke gembok (enzim). Inhibitor kompetitif adalah kunci palsu yang bentuknya mirip, sehingga bersaing untuk masuk ke gembok yang sama. Jika konsentrasi kunci palsu lebih tinggi, ia akan lebih sering masuk dan menghambat masuknya kunci asli.
Inhibitor Non-kompetitif: Bayangkan gembok (enzim) yang memiliki pegangan tambahan selain lubang kunci (situs alosterik). Inhibitor non-kompetitif mengikat pegangan tambahan ini, mengubah bentuk gembok sehingga kunci asli (substrat) tidak dapat masuk dengan mudah atau sama sekali.
Implikasi Medis Inhibitor Enzim
Inhibitor enzim memiliki peran penting dalam pengobatan berbagai penyakit. Kemampuannya untuk menghambat enzim spesifik menjadikannya target yang efektif dalam pengembangan obat. Contohnya, inhibitor protease digunakan dalam pengobatan HIV, sementara inhibitor ACE digunakan untuk mengontrol tekanan darah.
Penggunaan Inhibitor Enzim dalam Pengobatan
Penggunaan inhibitor enzim dalam pengobatan sangat luas dan terus berkembang. Pengembangan inhibitor yang spesifik dan efektif untuk enzim yang terlibat dalam berbagai penyakit merupakan kunci dalam pengembangan terapi baru dan yang lebih efektif. Dengan memahami mekanisme kerja inhibitor enzim, kita dapat merancang obat yang lebih tepat sasaran dan meminimalkan efek samping.
Ringkasan Akhir
Jadi, ternyata enzim bukan sekadar protein sederhana! Kombinasi rumit dari protein, kofaktor, dan koenzim, ditambah pengaruh faktor lingkungan, menentukan bagaimana enzim bekerja secara optimal. Pemahaman mendalam tentang komponen penyusun enzim ini membuka jalan bagi pengembangan obat-obatan, teknologi enzim, dan berbagai aplikasi bioteknologi lainnya yang dapat meningkatkan kualitas hidup manusia. Masih banyak misteri yang menunggu untuk diungkap dalam dunia enzim, dan penelitian terus berlanjut untuk menguak rahasia di balik keajaiban biokatalis ini.


What's Your Reaction?
-
0
 Like
Like -
0
 Dislike
Dislike -
0
 Funny
Funny -
0
 Angry
Angry -
0
 Sad
Sad -
0
 Wow
Wow

